
Лимонная кислота
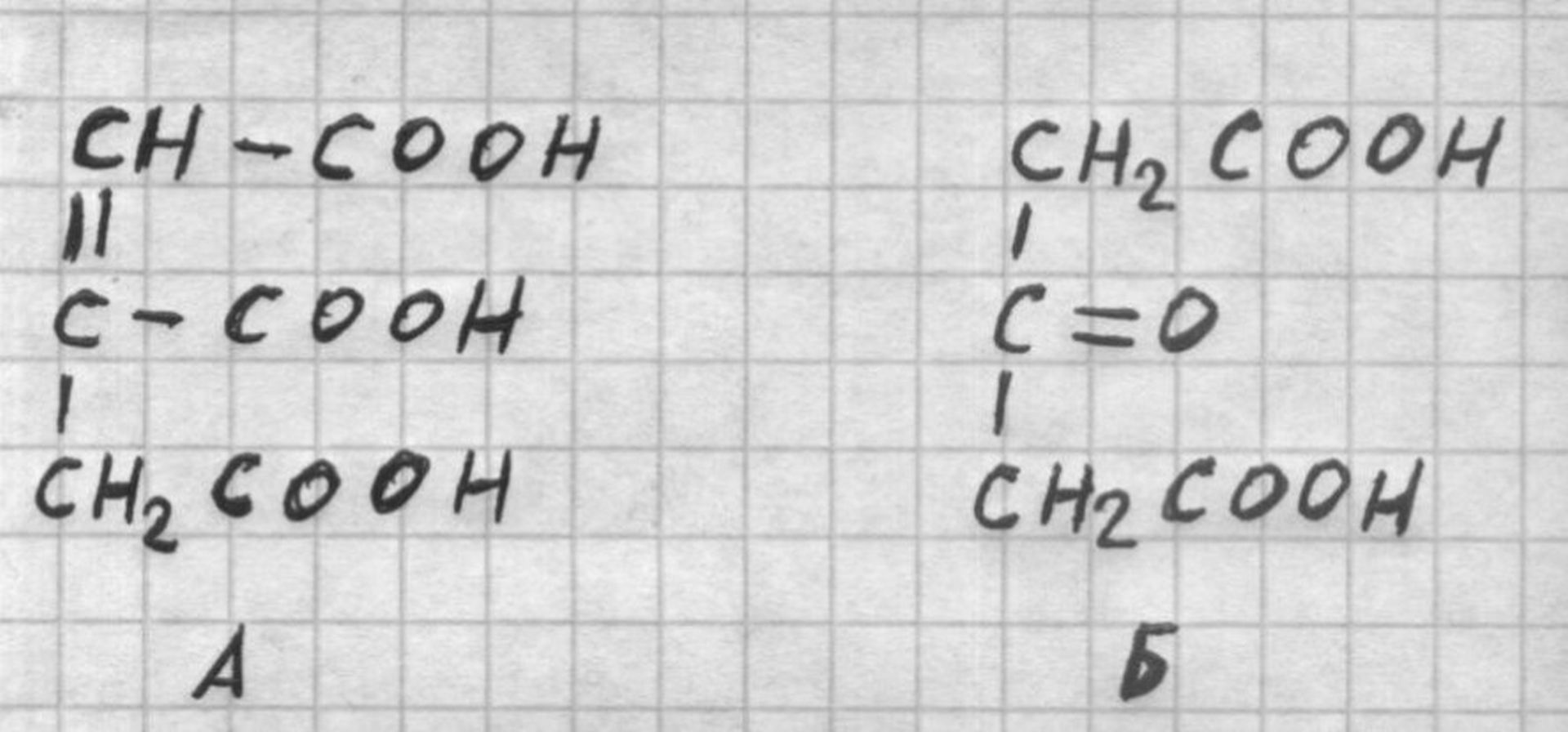
При нагревании до 175°С лимонная кислота переходит в аконитовую (А) и ацетондикарбоновую (Б) кислоты
Лимонная кислота (CH2COOH)2 C(OH)COOH — одноводный кристаллогидрат. Температура плавления безводной лимонной кислоты составляет 153°С. Плотность 1, 542 г/см3. Хорошо растворима в воде: 133 грамма в 100 граммах воды при 20°С. Также растворяется в спирте, диэтиловом эфире.
При нагревании до 175°С лимонная кислота переходит в аконитовую (А) и ацетондикарбоновую (Б) кислоты, выше 175°С образует итаконовую кислоту.
При прокаливании лимонной кислоты со щёлочью образуются соли щавелевой и уксусной кислот.
Лимонная кислота обнаруживает обычные свойства многоосновных кислот, давая три ряда солей и эфиров — кислых и полных; плохо растворимы соли щелочноземельных металлов. Лимонная кислота может быть проацилирована по ОН-группе.
Лимонная кислота широко распространена в природе, относительно много её содержится в некоторых ягодах, фруктах, особенно в цитрусовых (в лимоне 6-8%). Значительные количества лимонной кислоты содержатся также в листьях хлопчатника и стеблях махорки, откуда её и выделяют (один из промышленных способов).
Лимонную кислоту выделяют в виде лимоннокислого кальция из продуктов переработки хвои ели или плодов лимона, а также получают из растворов сахара с помощью некоторых грибков.
Лимонная кислота находит значительное применение в фармакологии и пищевой промышленности (в приготовлении напитков, кремов, желе и т.д.).
В небольшом количестве её употребляют в производстве некоторых алкидных смол. Триэтиловый и трибутиловый эфиры лимонной кислоты служат пластификаторами при производстве лаков и прочих.